El doctor Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA, señaló en una videoconferencia de prensa que los ensayos de vacunas para niños continúan y que la agencia “tiene que esperar a que la compañía envíe los datos de esos ensayos» para que se tenga un buen conjunto de datos de seguridad.
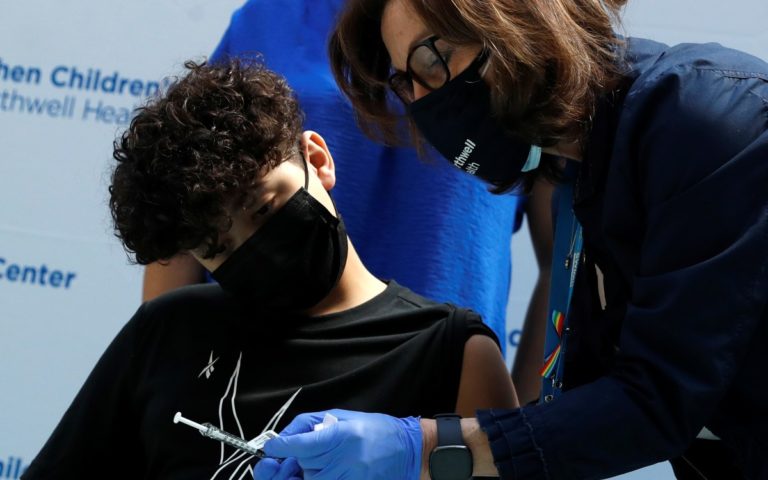
Mientras que la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) decidió dar la autorización completa a la vacuna contra la Covid-19 de los laboratorios Pfizer/BioNTech, para su aplicación en mayores de 16 años, también advirtió contra su uso no autorizado en menores de 12 años.
La vacunación para menores entre 12 y 15 años podría darse mediante una autorización de uso de emergencia. Sin embargo, no existe autorización de esta vacuna en modalidad alguna para ser aplicada a menores de 12 años. Si bien está previsto que en los próximos meses pudiera autorizarse su aplicación en niños pequeños, antes se debe contar con los resultados de los ensayos clínicos al respecto.
La FDA advierte que “no sería apropiado” aplicar en estos momentos la vacuna a ese grupo de la población, para quien no se ha definido cuál sería una dosis adecuada.
“No tenemos datos sobre la dosis adecuada ni tenemos datos completos sobre la seguridad en niños menores de lo que figura en la autorización de uso de emergencia”, aseguró este lunes la comisionada interina de la FDA, doctora Janet Woodcock, en declaraciones recogidas por la cadena CNN.
“Por lo tanto, sería una gran preocupación que la gente vacunara a los niños porque no tenemos la dosis adecuada y no tenemos los datos de seguridad, ni tampoco todos los datos de eficacia”, mencionó. “No recomendamos que los niños menores de 12 años se vacunen con esta vacuna. No sería apropiado”, dijo la funcionaria.
Por su parte, el doctor Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA, señaló en una videoconferencia de prensa que los ensayos de vacunas para niños continúan y que la agencia “tiene que esperar a que la compañía envíe los datos de esos ensayos para que que tenemos un buen conjunto de datos de seguridad, porque ciertamente queremos asegurarnos de hacerlo bien en los niños de 5 a 11 años y luego incluso en los niños más pequeños después de eso “.
Marks señaló que la FDA “obviamente actuará con rapidez una vez que se envíen esos datos, pero primero se deben terminar los ensayos, o al menos la parte de los ensayos que se nos puede enviar debe terminar”.
Mientras tanto, el director ejecutivo de Pfizer, Albert Bourla, comentó a la cadena NBC este lunes que la compañía está realizando “estudios muy grandes en este momento” con niños menores de 12 años. Mencionó que confía en que los estudios en niños de 5 a 11 años se completen en septiembre y que posteriormente el laboratorio enviará la información a la FDA.
En julio, la FDA pidió un seguimiento de cuatro a seis meses en los ensayos clínicos en niños, a diferencia de los ensayos en adultos, que requieren dos meses. Además, pidió que se duplique la cantidad de niños de 5 a 11 que participan en los ensayos clínicos.
La Academia Estadounidense de Pediatría (AAP, por sus siglas en inglés) pidió a la FDA que “trabaje enérgicamente para autorizar una vacuna para niños de 11 años o menos”, en momentos en que la variante delta se propaga por todo el país entre las personas no vacunadas, incluidos los niños. También desaconsejó el uso de la vacuna en menores de 12 años.
“Los ensayos clínicos para la vacuna Covid-19 en niños de 11 años o menos están en marcha, y necesitamos ver los datos de esos estudios antes de administrar esta vacuna a los niños más pequeños”, dijo el presidente de la AAP, Lee Savio Beers, en el comunicado.
Enfatizó que la dosis puede ser diferente para edades más jóvenes. “La AAP recomienda no administrar la vacuna a niños menores de 12 años hasta que la FDA lo autorice “, puntualizó.

 Policiacahace 1 día
Policiacahace 1 día
 Méxicohace 1 día
Méxicohace 1 día
 Opiniónhace 2 días
Opiniónhace 2 días
 Juárezhace 1 día
Juárezhace 1 día


